Hướng dẫn sử dụng
Máy đo pH là gì? Ứng dụng của Bút đo pH là gì?
Máy đo pH là gì
- Máy đo pH cầm tay là thiết bị kiểm tra độ pH thiết kế cầm tay nhỏ gọn, dễ dàng mang theo sử dụng.
- Máy đo pH để bàn là dụng cụ đo pH để bàn, dùng trong phòng thí nghiệm.
- Bút đo PH là thiết bị đo thử pH dạng bút nhỏ gọn nhất. Kích thước của nó chỉ bằng một chiếc bút sáp thông thường. Rất tiện lợi. Tuy nhiên lại bị hạn chế về tính năng.
Ứng dụng của máy đo pH là gì?:
Phép đo pH – Ebook hướng dẫn Lý thuyết về pH
Sổ tay hướng dẫn Lý thuyết về pH tập trung vào việc đưa ra mô tả rõ ràng và thiết thực về cách đo pH trong môi trường thí nghiệm và thực địa. Nhiều mẹo và gợi ý được đưa ra cho các điểm quan trọng và toàn bộ phần mô tả phép đo sẽ được hỗ trợ bởi phần mô tả lý thuyết về phép đo độ axit và kiềm. Sự chú ý cũng được dành cho các loại điện cực pH khác nhau có sẵn và các tiêu chí lựa chọn điện cực phù hợp
cho một mẫu cụ thể.
Mục lục:
- Giới thiệu về pH.
- Lựa chọn và xử lý điện cực
- Sổ tay hướng dẫn xử lý sự cố cho phép đo pH
- Lý thuyết toàn diện về pH
Độ pH là gì?
Tại sao chúng ta phân loại một chất lỏng như giấm là có tính axit? Lý do cho điều này là giấm có chứa dư thừa ion hydroium (H3O+) và sự dư thừa ion hydronium trong một dung dịch khiến nó có tính axit. Ngược lại, sự dư thừa ion hydroxyl (OH–) tạo ra chất trung tính hoặc có tính kiềm. Trong nước tinh khiết, ion hydronium bị trung hòa bởi ion hydroxyl và dung dịch này có giá trị pH trung tính.
H3O+ + OH– ↔ 2 H2O
Hình 1. Phản ứng giữa axit và bazơ tạo ra nước
Nếu các phân tử của một chất sản sinh ra ion hay proton hydro thông qua sự phân ly, chúng ta gọi chất này là axit và dung dịch trở nên có tính axit. Một số loại axit được biết đến nhiều nhất là axit hydrocloric, axit sulfuric và axit acetic hay giấm. Sự phân ly của giấm được thể hiện dưới đây:
CH3COOH + H2O ↔ CH3COO– + H3O+
Hình 2. Sự phân ly của axit acetic.
Không phải mọi axit đều có độ bền như nhau. Độ axit của một chất được xác định bởi tổng số ion hydro trong dung dịch. Giá trị pH được xác định là trừ logarit của nồng độ ion hydro. (Một cách chính xác, nó được xác định bởi hoạt tính của ion hydro. Xem chương 4.2 để biết thêm thông tin về hoạt tính của ion hydro).
pH = –log [H3O+]
Hình 3. Công thức tính giá trị pH từ nồng độ ion hydronium.
Sự khác biệt về lượng giữa các chất có tính axit và bazơ được xác định bằng cách thực hiện phép đo giá trị pH. Một số ví dụ về giá trị pH của các chất thường gặp được cho trong hình 4:
1.1. Axit hay bazơ
1.2. Tại sao giá trị pH được đo?
1.3. Các công cụ đo pH
a) Điện cực pH
b) Điện cực tham chiếu
c) Điện cực kết hợp
1.4. Sổ tay hướng dẫn thực tiễn cho phép đo pH chính xác
a) Chuẩn bị mẫu
b) Hiệu chuẩn
c) Điện cực pH
d) Độ chính xác kỳ vọng cho phép đo
1.5 Sổ tay hướng dẫn từng bước cho phép đo pH
Để có phép đo pH tối ưu, trước tiên điện cực phải được lựa chọn chính xác.
Các tiêu chí mẫu quan trọng nhất cần cân nhắc là: thành phần hóa học, độ đồng nhất, nhiệt độ, phạm vi pH và kích thước vật chứa (giới hạn chiều dài và chiều rộng). Việc lựa chọn trở nên đặc biệt quan trọng đối với các mẫu không chứa nước, dẫn điện thấp, giàu protein và nhớt, vì với các mẫu này, điện cực thủy tinh thông thường dễ phát sinh nhiều lỗi khác nhau.
Thời gian đáp ứng và độ chính xác của một điện cực phụ thuộc vào một số yếu tố. Việc đo trong môi trường có pH và nhiệt độ cực trị hoặc độ dẫn điện thấp có thể mất nhiều thời gian hơn so với đo trong dung dịch chứa nước ở nhiệt độ phòng với pH trung bình.
Ý nghĩa của các loại mẫu khác nhau được trình bày dưới đây bằng cách lấy các đặc điểm điện cực khác nhau làm điểm khởi đầu. Điện cực pH kết hợp được thảo luận chủ yếu trong chương này.
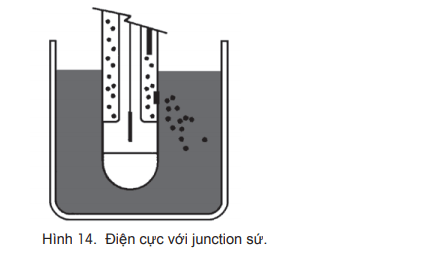
Chỗ tiếp xúc giữa phần điện cực tham chiếu với mẫu có thể có một số dạng khác nhau. Những dạng này đã phát triển theo thời gian vì các yêu cầu khác nhau đối với điện cực khi đo các mẫu đa dạng. Junction “tiêu chuẩn” là đơn giản nhất và được gọi là junction sứ. Nó chứa một mảnh sứ rỗng được đẩy qua trục thủy tinh của điện cực. Mảnh sứ rỗng này cho phép chất điện ly
đi từ từ qua điện cực, nhưng ngăn cản nó tràn ngoài một cách tự do.
Loại junction này rất phù hợp cho các phép đo tiêu chuẩn trong dung dịch chứa nước ; InLab®Routine Pro của METTLER TOLEDO là một ví dụ cho loại điện cực này. Hình minh họa cấu tạo của junction này được thể hiện trong hình 14.
a) Điện cực pH
Điện cực pH chính là phần cảm nhận pH trong dung dịch. Nó bao gồm một trục thủy tinh với màng thủy tinh mỏng ở cuối, nhạy
cảm với ion H+. Phần bên ngoài màng thủy tinh này tạo thành một lớp gel khi màng tiếp xúc với dung dịch nước. Lớp gel tương tự cũng được tạo thành ở bên trong màng thủy tinh, vì điện cực có chứa dung dịch điện ly có nước. Một ví dụ về lớp gel này được thể hiện trong hình dưới đây:
Các ion H+ bên trong và xung quanh lớp gel có thể khuếch tán vào hoặc ra khỏi lớp này, tùy vào giá trị pH cũng như nồng độ ion H+ của dung dịch được đo. Nếu dung dịch có tính kiềm, các ion H+ sẽ khuếch tán ra khỏi lớp này và điện tích âm được tạo ra trên mặt ngoài của màng. Vì điện cực thủy tinh có lớp đệm bên trong có giá trị pH không đổi, nên điện thế trên mặt bên trong của màng duy trì không đổi trong quá trình đo. Do đó điện thế trên điện cực pH là sự chênh lệch giữa điện tích bên trong và bên ngoài màng.

Một bản vẽ điện cực pH tiêu chuẩn được thể hiện trên hình 9.
H+ H+b) Điện cực tham chiếu
Mục đích của điện cực tham chiếu là cung cấp một điện thế tham chiếu xác định và ổn định để đo điện thế cảm biến pH. Để làm điều này, điện cực tham chiếu cần được làm bằng thủy tinh không nhạy cảm với ion H+ trong dung dịch. Nó cũng phải tiếp xúc với môi trường mẫu mà nó được nhúng vào. Để đạt được điều này, một cửa mở hay junction được tạo ra trong trục của điện cực tham chiếu mà qua đó, dung dịch bên trong hoặc chất điện phân tham chiếu có thể di chuyển vào mẫu. Điện cực tham chiếu và pin bán phần pH phải ở trong cùng một dung dịch để phép đo chính xác. Hình vẽ điện cực tham chiếu điển hình được thể hiện dưới đây:
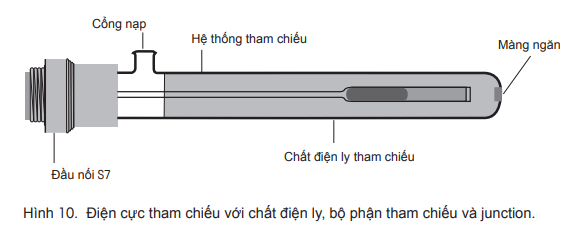
Có một số hệ thống tham chiếu, nhưng ngày nay được sử dụng nhiều nhất là hệ thống bạc/bạc clorua. Điện thế của hệ thống tham chiếu này được xác định bởi chất điện ly tham chiếu và bộ phận tham chiếu bạc/bạc clorua. Điều quan trọng là chất điện ly tham chiếu có nồng độ ion cao, dẫn đến điện trở thấp (xem chương 4.4 để biết thêm chi tiết).
Vì chất điện ly tham chiếu chảy vào dung dịch mẫu trong khi đo nên cần phải chú ý đến phản ứng có thể xảy ra giữa chất điện ly tham chiếu và dung dịch mẫu, vì điều này có thể ảnh hưởng đến điện cực và phép đo (xem chương 2.2 để biết thêm thông tin).
c) Điện cực kết hợp
Điện cực kết hợp (hình 11) được sử dụng phổ biến ngày nay và dễ xử lý hơn nhiều so với hai điện cực riêng biệt. Trong điện cực kết hợp, điện cực thủy tinh nhạy cảm với pH được bao quanh đồng tâm bởi điện cực tham chiếu chứa chất điện ly tham chiếu.
Các phần tham chiếu và pH riêng biệt của điện cực kết hợp có cùng những thuộc tính như các điện cực riêng biệt; sự khác biệt duy nhất là chúng được kết hợp thành một điện cực để dễ sử dụng. Chỉ khi hai thành phần của điện cực kết hợp có tuổi thọ khác nhau thì các điện cực pH và tham chiếu riêng biệt mới được khuyến nghị thay thế cho điện cực kết hợp.
Để đơn giản hóa phép đo pH, cảm biến nhiệt độ có thể được đưa vào cùng với các bộ phận pH và tham chiếu. Điều này cho phép thực hiện phép đo có bù trừ nhiệt độ. Điện cực như vậy cũng được gọi là điện cực 3 trong1.
 .. xem thêm trong Ebook hướng dẫn đo pH và tìm hiểu định nghĩa pH ….
.. xem thêm trong Ebook hướng dẫn đo pH và tìm hiểu định nghĩa pH ….Các vấn đề phát sinh khi đo pH có thể xuất phát từ các nguồn khác nhau; từ máy đo, cáp và điện cực, đến các dung dịch đệm, nhiệt độ đo và mẫu (ứng dụng). Cần chú ý đặc biệt đến các triệu chứng của vấn đề vì chúng giúp xác định nguồn gây lỗi. Bảng sau cung cấp thông tin tổng quan về các triệu chứng và nguyên nhân:
Chỉ số quá cao/quá thấp hoặc vượt ngoài thang đo “—”
- Kiểm tra máy đo, cáp, điện cực, quy trình hiệu chuẩn và nhiệt độ mẫu
Giá trị không thay đổi
- Kiểm tra máy đo, cáp và điện cực
Thời gian đáp ứng chậm
- Kiểm tra điện cực và mẫu/ứng dụng
Độ lệch cao sau khi hiệu chuẩn
- Kiểm tra điện cực, dung dịch đệm và quy trình hiệu chuẩn
Độ dốc thấp sau khi hiệu chuẩn
- Kiểm tra điện cực, dung dịch đệm và quy trình hiệu chuẩn
Lỗi hiệu chuẩn
- Kiểm tra máy đo, cáp, điện cực, dung dịch đệm và quy trình hiệu chuẩn
Các giá trị đo bị xê dịch
- Kiểm tra điện cực và mẫu/ứng dụng
… xem thêm trong Hướng dẫn đo PH
Trong các phần trước, các khía cạnh thực tiễn của phép đo pH đã được thảo luận. Chương này sẽ chủ yếu nói về kiến thức lý thuyết cho phép đo pH và dành cho người đọc muốn có thêm hiểu biết cơ bản về lý thuyết pH.
Đầu tiên, lý thuyết cơ bản về pH sẽ được phát triển, sau đó chúng ta sẽ xét đến lý thuyết về cảm biến và cuối cùng một số chủ đề đặc biệt sẽ được thảo luận.
4.1 Định nghĩa về giá trị pH
Theo Sørenson, pH được định nghĩa là trừ logarit của nồng độ ion H3O+:
pH = –log [H3O+]
Từ công thức này chúng ta có thể thấy rằng nếu nồng độ ion H3O+ thay đổi mười lần, giá trị pH sẽ thay đổi một đơn vị. Điều này thể hiện tầm quan trọng của việc đo lường sự thay đổi dù nhỏ nhất trong giá trị pH của mẫu.
Lý thuyết về pH thường được mô tả với ion H+ liên quan đến giá trị pH, mặc dù ion chính xác là ion hydronium (hoặc có tên chính thức theo IUPAC là: oxonium) (H3O+):
H+ + H2O ↔ H3O+
Không chỉ axit và bazơ thể hiện sự phân ly để hình thành các ion hydronium hoặc ion hydroxide, nước tinh khiết cũng phân ly để tạo thành các ion hydronium và hydroxide:
2 H2O ↔ H3O+ + OH–
… xem thêm trong Hướng dẫn đo PH
4.1. Định nghĩa giá trị pH
4.2. Mối tương quan giữa nồng độ và hoạt độ
4.3. Dung dịch đệm
Khả năng đệm (ß)
Giá trị loãng (ΔpH)
Hiệu ứng nhiệt độ (ΔpH/ΔT)
4.4. Chuỗi đo trong việc thiết lập phép đo pH
Điện cực pH
Điện cực tham chiếu
4.5. Hiệu chỉnh/điều chỉnh thiết lập phép đo pH
4.6. Ảnh hưởng của nhiệt độ trong phép đo pH
Sự phụ thuộc vào nhiệt độ của điện cực
Giao cắt đẳng nhiệt
Các hiện tượng nhiệt độ khác
Sự phụ thuộc vào nhiệt độ của mẫu đo
4.7. Các hiện tượng trong trường hợp dung dịch đo đặc biệt
Lỗi bazơ
Lỗi axit
Phản ứng với chất điện phân tham chiếu
Phương tiện hữu cơ
Bạn đang xem bài viết máy đo PH là gì? Bài viết tiếp theo ta cùng Máy đo thử PH là gì? Tại sao việc hiệu chuẩn máy thử PH lại quan trọng